Proteínas 1
Las proteínas son la principal fuente de N en la alimentación y son utilizadas para fabricar las proteínas que nosotros necesitamos.
Las proteínas son polímeros de aminoácidos que tienen diferente nivel de estructuración (lo veremos en otra página). Las proteínas son muy relevantes en los organismos porque cumplen una gran cantidad de funciones. Podemos enlistarlas:
- Catálisis enzimática
- Estructural: Soporte mecánico
- Transporte y almacenamiento
- Movimiento coordinado
- Protección inmune
- Generación y transmisión de impulsos nerviosos
- Control de crecimiento y diferenciación
Aminoácidos
En realidad el pH por arriba o por debajo del cual estos grupos -el amino y el ácido- estarán disociados o no, dependerá de su pK (recuerda la clase de acidez: pH: soluciones amortiguadoras). Este pK depende del tipo de R que tenga, pero en general para los alfa-aminoácidos, el pKa del grupo carboxilo está entre 2.3 y 4.76, mientras que el pK del grupo amino está entre 9.2 y 10.
Así que para pHs entre 5 y 9, los alfa-aminoácidos tendrán estos dos grupos funcionales con carga, uno disociado (el ácido) y otro sin disociar (la amina).
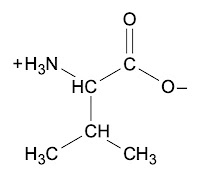
Por esta razón, los aminoácidos siempre tienen las dos cargas, positiva y negativa, es decir, son un doble ion, al que comúnmente llamamos zwitterion, por la palabra alemana zwitter: doble sexo (hermafrodita, híbrido). Así que zwitterion indica ion con ambas cargas positivas y negativas. Algunos incluso llegan a tener más de una carga, pero siempre nos referimos a ellos como zwitterion para indicar que tienen cargas positivas y negativas en la misma molécula.
El isómero en el cual están la mayor parte de los aminoácidos es el L y no el D. Si no recuerdas que significa esto, te recomiendo que revises mi blog sobre isomerías en Fundamentos químicos de biomoléculas.
Quiz: ¿Por qué nunca mencionamos L-glicina pero sí a otros como L-alanina?
Clasificación
¿Qué es GIMVAL FYW COSITA-PEQUENA HARK DEDO?
Dado que la mayoría de los aminoácidos son alfa, la clasificación solo se basa en la R, es decir, la cadena lateral. Para no referirnos a ellos con el nombre completo, hay dos tipos de nomenclatura, una de tres letras y otra con solo una.
La verdad es que utilizamos más la nomenclatura de una letra (N1) que la de tres (N3). Apréndetela porque la verás en muchos textos. La de una letra la verás en textos de genética, biología molecular y biotecnología. La de tres letras se usa poco, algunos textos de bioquímica y fisiología todavía la usan.
No polares, alifáticos
En estos, la nomenclatura es relativamente sencilla, la primera letra con la que inicia su nombre es su abreviación en la nomenclatura de 1 letra. Ellos son GIMVAL: G-I-M-V-A-L. (mnemotecnia GIMVAL)
Estructura N3 N1
Polares no cargados
En estos, su abreviatura también es la primera letra de su nombre. Con excepción de Asparagina y glutamina que son derivados de otros aminoácidos (de los ácidos). Ellos son CSTP y NQ: C-S-T-P-Q-N. (mnemotecnia: CoSiTa PeQueNa). Notarás que la prolina, en realidad es un iminoácido (recuerda la nomenclatura orgánica: Notas sobre Química Orgánica).
Estructura N3 N1
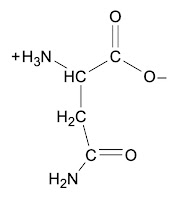
Polares cargados ácidos
Su cadena lateral tiene un grupo ácido que a pH 7 está disociado, por eso se clasifican como cargados, o simplemente ácidos. Son dos, aspártico y glutámico, pero como las letras iniciales ya estaban ocupadas para otros aminoácidos y como no se podía usar la primera/segunda consonante (que no estuviera ya usada en la nomenclatura), entonces se decidió ponerle D al aspártico y E al glutámico, juntos -porque se parecen- en el abecedario y dado que el glutámico es más largo, va después que el aspártico. (Mnemotecnia: DEdo).
Estructura N3 N1
Polares cargados básicos
Su cadena lateral tiene un grupo amino que a pH 7 está cargado -no disociado-, por eso se clasifican como cargados, o simplemente básicos. Son tres: Arginina, Histidina y Lisina. Se abrevian con la primer consonante que no estaba ocupada ya por otros aminoácidos: aRginina, Histidina. Como en Lisina ya todas sus consonantes estaban ocupadas para otros aminoácidos, entonces se le puso K. (Mnemotecnia: HaRK)
Estructura N3 N1
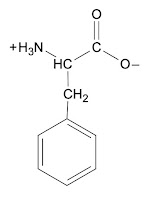
Polares non polares aromáticos
Estos fueron los últimos en asignárseles abreviatura, así que quedaron medios raras. En la clasificación siempre se colocan junto a los alifáticos, porque también son no polares.
Fenilalanina, (alanina con fenilo), fue el único en el que su letra inicial se podía usar para abreviatura: F. Para tirosina, se usó la primera consonante que no fuera usada (T ya estaba usada para treonina), en francés Tirosina es tYrosine, así que como la Y es consonante, se usó esta para Tirosina.Como ya no había otras consonantes disponibles, se usó la más cercana a Y, la W para triptófano, porque todas sus consonantes ya estaban usadas para otros aminoácidos.Mnemotecnia: FYW ('fiu')
Estructura N3 N1
(aislada por primera vez en 1877 por Schulze)
Seguramente, te preguntarás, ¿Porqué no usar la B, la X o la Z? Bueno, para la asparragina se usó la primer consonante disponible: la N, y para la glutamina que es parecida (como el glutámico al aspártico) se usó la primer consonante disponible del abecedario después de la N, es decir, se le asignó la Q. En algunos casos, algunas estructuras pueden tener asparragina o aspartato: en ese caso se utiliza B, para simbolizar que puede ser alguno de los dos, y Z para simbolizar que puede ser glutamina o glutamato). Para referirnos a cualquier aminoácido utilizamos la X. Te darás cuenta que solo quedan tres letras sin usar, la J, la O y la U. Bueno, la o podría usarse para ornitina y la U generalmente se usa para simbolizar uracilo (en el ARN), la J aún no se usa.
Bueno estos 20 aminoácidos, están codificiados en los genes y pueden ser usados para sintetizar las proteínas, por eso se les llama proteinogénicos. Algunos pueden ser modificados, como la cisteína, como veremos más adelante. Hay otros dos aminoácidos proteinogénicos que algunas bacterias y arqueas utilizan, la selenocisteína y la pirrolisina. Pero son poco comunes, por los que no los mencionamos mucho.
Para que recuerdes a todos los proteinogénicos usa la mnemotecnia:
GIMVAL FYW, COSITA-PEQUENA! HARK! DEDO
Propiedades químicas de los aminoácidos
Los aminoácidos aromáticos absorben la luz ultravioleta entre 260 y 280 nm. Las longitudes de onda de máxima absorción son: F a 257 nm, Y a 275 nm y W a 280 nm. Esta propiedad es utilizada para determinar -de manera no tan exacta-, la cantidad o concentración de proteínas. La histidina fluoresce levemente a 280 nm, por lo que puede presentar un poco de interferencia. El triptófano emite a 308-350 nm, dependiendo del solvente o ambiente en el que se encuentre. A este fenómeno se le llama solvatocromismo. Resulta de especial importancia, porque la absorción y emisión de luz del triptófano, dependerá del ambiente en el que se encuentre, así que dependerá de la estructura secundaria y terciaria de la proteína. Por ejemplo, si está en cercanía de grupos protonados, esta fluorescencia es "quencheada", apagada.
punto isoeléctrico
Dado que los aminoácidos tienen una porción polar, todo son solubles o parcialmente solubles en agua. Como vimos arriba, forman un zwitterion. Como el grupo amino, tiene un efecto inductivo de atraer electrones del C alfa. El grupo ácido de los aminoácidos es más ácido. Por ejemplo. El pK del acético está entre 4-5, y el pK de la glicina es de 2.4.
Cuando se colocan en un campo eléctrico, estos emigrarán dado que tienen carga. Pero ¿hacia dónde migrarían hacia el cátodo (de carga negativa) o hacia el ánodo?
Emigrarán dependiendo del ion predominante, cuando se disuelve, generan una solución ligeramente ácida, por lo que predomina el anión -de carga negativa- así que migraría hacia el ánodo (que tiene carga positiva). Sin embargo, si se incrementa el pH se logrará llegar a un pH donde la concentración del catión (el amonio) y el anión (el carboxilato) sea igual. Este valor de pH, se conoce como punto isoeléctrico, pI. En este pH, el zwitterion aminoácido no migrará hacia ninguno. A pHs por arriba del pI, se comporta predominantemente como catión y entonces migrará hacia el cátodo.
El pI se calcula como el promedio de los pK de cada grupo funcional. Pero en péptidos es diferente (lo veremos más adelante). Un aminoácido o una proteína no migrarán a su pI, y la suma de sus cargas es igual a 0.
Se comportan como hidroxiácidos. De esta forma, el grupo amino, se comporta un poco como si fuera un -OH.
Esto hace que cuando se calientan, pueden formar el grupo amida con el grupo alfa-amino. El oxígeno reacciona con los hidrógenos de la amina de otro aminoácido, desprendiéndose como agua, y generando un enlace amido.
Enlace peptídico
De hecho debido a esto, el grupo amino de un aminoácido, puede actuar como nucleófilo del Carbono electrofílico del carboxilo de otro aminoácido, generando una amida característica, que llamamos enlace peptídico.
Este enlace peptídico, no es como cualquier otra amida:
Una de las principales diferencias, es que, el Nitrógeno en una amida, es principalmente tetraédrico, por lo que sus otras dos uniones (con el Carbono alfa del sig. aminoácido y el hidrógeno, marcados como 2 y 3 en rojo en la figura) no están en el mismo plano que la unión entre el Carbono del carbonilo y el Nitrógeno (marcado como 1 en rojo en la figura de arriba). A diferencia, el enlace peptídico es casi planar, es decir, los enlaces 1, 2 y 3 están casi en un mismo plano.
De esta manera, se pueden unir varios aminoácidos, con la unión del carboxilo de uno con el amino del siguiente. Esta "polimerización" lineal da origen a los que llamamos péptidos, que pueden tener desde dos hasta cientos de aminoácidos.
Este por ejemplo, está hecho de 6 aminoácidos, por lo que le llamamos hexapéptido. Así, se usan los prefijos griegos de cantidad, generalmente no se usan cuando son más de once, a los que simplemente se les llama oligopéptido (del griego oligos ὀλιγο- varios) o polipéptido (del gripo poli πολυ- muchos). ¿Cuál es la diferencia entre varios y muchos? cada quien tiene su criterio, no? por eso no hay una convención precisa sobre cuántos aminoácidos hay entre oligopéptido y polipéptido, solo sabemos que al compararlos, polipéptido tiene más que un oligopéptido.Cuando los aminoácidos están formando péptidos, les llamamos residuos. Por ejemplo, en el siguiente péptido:
AMRIDE
Decimos que la Arginina es el residuo tres (tercer residuo) de este péptido.
El Aspartame tiene dos residuos D y F, es un dipéptido. El primero es el ácido aspártico. Pero...
¿Cómo sabemos desde dónde empezar a contar?
Siempre se cuenta desde la izquierda, y por convención, el aminoácido que está hasta la izquierda (la primera posición) tiene su grupo amino libre, por lo que le llamamos el amino terminal o N-terminal. Así, el último (hasta la derecha) tiene el ácido carboxílo o carboxilo libre (sin formar enlace peptídico), por lo que se llama carboxilo terminal o C-terminal. Notarás que las figuras más arriba, así están colocadas. En el ejemplo anterior AMRIDE, el N-terminal es una alanina, y el C-terminal es un glutámico.
El pI de un polipéptido depende de muchos factores, la primer aproximación sería el promedio de los pKs de las cadenas laterales de los residuos de los aminoácidos, pero cuando un polipéptido está en solución, algunas cadenas quedan plegadas dentro del mismo péptido, por lo que no están expuestas al agua, por lo que el pI será diferente.
Ninhidrina
Las aminas alfa a un grupo carboxilo y a un grupo carbonilo/aldehido, pueden reaccionar con la ninhidrina, generando un compuesto decolor azul-púrpura o violeta que absorbe a 570 nm, y que denominamos Púrpura de Ruhemann. Los aminoácidos pero también algunos aminoaldosas (como la glucosamina) dan positivo a esta prueba. Así que se puede utilizar para identificar cuando hay estos grupos e incluso cuantificarlos, pero no para diferenciarlos. La prolina no genera este color, sino un color amarillento.
De hecho, esta reacción es una oxidación, dado que el Carbono alfa pasa de grado de oxidación 1 a 2 y el carboxilo se elimina (descarboxilación). El Carbono alfa, es fácilmente oxidable, debido al efecto inductivo del nitrógeno y del oxígeno de los alfa-aminoácidos. De esta manera, es muy común que cuando los aminoácidos se desaminan, este proceso sea oxidativo, al que llamamos desaminación oxidativa.
También otros oxidantes pueden realizarlo. Por ejemplo, cuando los alfa-aminoácidos se hacen reaccionar con ácido nitroso (HNO2), se desprende nitrógeno gaseoso (N2) y en lugar de cetoácido queda como hidroxiácido. Este análisis se llama de Van Slyke.
Estas reacciones ocurren con la amina primaria, así que el amino que está formando un enlace peptídico no sufre estas reacciones.
Bases de Schiff
El grupo amino, puede reaccionar con formaldehído, benzaldehído, glutaraldehído o incluso el aldehído de aldosas (como de la glucosa, por ejemplo), para generar una imina llamada Base de Schiff
Esta reacción se puede dar durante la glicación (glicosilación no enzimática), el pardeamiento (como el bronceado del pan o del caramelo) por calor o por la exposición constante a azúcares, como en la diabetes. Y puede afectar enormemente la función de las proteínas.
Reacciones del tiol
La cisteína, sola o dentro de una cadena peptídica, presente un grupo tiol (-SH) que en presencia de oxidantes o por acción natural de algunas enzimas se oxida a sulfuro, pudiéndose unir a otra cisteína, generando un puente disulfuro.
Esta reacción se puede revertir por agentes reductores como:
- beta-Mercaptoetanol (βME o BME)
- Ditiotreitol (DTT)
- tris(2-carboxietil)fosfina (TCEP)
Los dos primeros reducen al disulfuro de manera reversible, mientras que el último, el TCEP, es más fuerte y no es reversible. Por esta razón, los dos primeros, BME y DTT deben usarse en exceso para favorecer la reducción del disulfuro a tiol. Cuando dos cisteínas solas forman este enlace disulfuro, se genera un diaminoácido llamado cistina. No es un dipéptido porque no está unido por enlace peptídico sino por el puente disulfuro. La cistina se aisló por primera vez de un cálculo renal en 1810 por William Wollaston, por eso recibió ese nombre (del griego cystis, κύστις, vejiga).
Los grupos tioles pueden reaccionar con algunos alquilantes como iodoacetamida (NH2COCH2I) para quedar permanentemente alquilados (acetamidados para ser preciso), con lo que ya no podrían oxidarse a disulfuro. Así que este reactivo tiende a utilizarse para evitar que los tioles se puedan oxidar y generar disulfuros.



























No hay comentarios:
Publicar un comentario