Hola de nuevo,
Veremos dos temas que son esenciales para entender las propiedades químicas de las biomoléculas, las isomerías (sí en plural, por los diferentes tipos) y la oxido-reducción (sí, también las moléculas orgánicas la sufren).
Isomería
La isomería se refiere a compuestos que tienen la misma fórmula química (fórmula condensada), es decir, el mismo contenido de átomos de C, H, etc. pero que presentan distintas propiedades físicas, químicas y biológicas. Cuando se habla de isómeros, siempre se habla de dos compuestos, es como hablar de primos. No dices ese es primo, sino ese es mi primo o primo de xxxx. Pues lo mismo con la isomería. Así que la isomería es siempre relativa a algún otro compuesto. Decimos "este compuesto es isómero de x".
Por cierto, por flojera, cuando me refiera a las propiedades físicas, químicas o biológicas, las vamos a abreviar PFQB. Intentaré estarte poniendo ejemplos que puedas relacionar conceptos, pero también para que notes la importancia de los isómeros. Aunque pueden tener la misma composición química, la actividad biológica definitivamente puede ser muuuuy diferente.
Empecemos, puede haber isomería estructural, geométrica, conformacional y óptica. En realidad, puede haber más, pero en estas nos centraremos porque son las más importantes para Bioquímica.
Isomería Estructural
Se refiere cuando la diferencia entre esos dos compuestos es un grupo funcional que es diferente (llamada isomería de grupo funcional) o que se encuentra en otra posición (llamada isomería funcional, isomería de posición o posicional, duh 😁).
Ambos son C10H16. Pero nota que uno tiene un grupo funcional diferente: limoneno un ciclo, y el mirceno un doble enlace más.
Sí, como te imaginarás, el limoneno da un olor a cítrico y el mirceno un olor aromático (como terroso-herbal). ¿Puedes imaginarte otros isómeros de grupo funcional?
No hay que confundir con la isomería funcional que es un tipo de isomería posicional, en donde el grupo funcional es el mismo pero cambia de posición, por ejemplo, la acetona y el propanaldehído.
Ejemplos de isómero de posición sería la glucosa  y la fructosa
y la fructosa  . Nota que ambas tienen el grupo carbonilo solo que uno lo tiene como aldehído (la glucosa) y otro como cetona (la fructosa).
. Nota que ambas tienen el grupo carbonilo solo que uno lo tiene como aldehído (la glucosa) y otro como cetona (la fructosa).
 y la fructosa
y la fructosa  . Nota que ambas tienen el grupo carbonilo solo que uno lo tiene como aldehído (la glucosa) y otro como cetona (la fructosa).
. Nota que ambas tienen el grupo carbonilo solo que uno lo tiene como aldehído (la glucosa) y otro como cetona (la fructosa).Hay un isómero de posición importante en bioquímica, los isómeros de fosfato, esto es cuando el grupo fosfato está en posición diferente. Por ejemplo, el 1,3-bi-fosfoglicerato (1,3-BPG) y el 2,3-bi-fosfoglicerato
(1,3-BPG) y el 2,3-bi-fosfoglicerato (2,3-BPG).
(2,3-BPG).
 (1,3-BPG) y el 2,3-bi-fosfoglicerato
(1,3-BPG) y el 2,3-bi-fosfoglicerato (2,3-BPG).
(2,3-BPG). El primero, 1,3-BPG es intermediario de la glucólisos, el segundo regula la afinidad de la hemoglobina por el oxígeno, permitiendo que nos adaptemos a cambios de presión a diferentes alturas, como cuando viajas de Ciudad de México a la playa.
Hay una estructura resonante conocida como tautomería que sí es una isomería porque en efecto el grupo funcional cambia. Los tautómeros tienen diferencias en el grupo funcional y diferencias en electrones. El ejemplo más típico es la prototropía. Esta se da porque tanto un Hidrógeno como un electrón cambiand e lugar (se desplazan). El ejemplo típico es la tautomería ceto-enol. El grupo Ceto con un enlace pi y un hidrógeno en carbono alfa, es resonante -es tautómero- del grupo enol (alcohol unido a un grupo alqueno). Nota en la figura como el doble enlace se "desplaza" y por eso pasa de grupo ceto- a alcohol.
A veces la resonancia no ocurre, y en realidad los isómeros se mantienen sin intercambiarse a la otra forma. Es decir, se mantienen preferentemente en una forma más que en otra.
Ejemplos: tautómeros cíclicos de glucopiranosa-glucofuranosa, y tautómeros imina-enamina, como el de la histidina y algunos metabolitos de bases nucleicas.







Pero, ¿qué provoca estos cambios? Bueno, eso será un tema que veremos en bioenergética.




















Isomería geométrica
Se refiere a la conformación cis o trans en un doble enlace. Cis se refiere a cuando los sustituyentes importantes (usualmente carbonos) están del mismo lado en el plano del doble enlace, trans cuando están en lados opuestos.
Muchos hemos escuchado de los ácidos grasos trans y lo peligroso que son para la salud, por lo que es mejor consumir los cis. Un ejemplo de un ácido graso cis, es el palmitoleato:
Nota cómo al ser cis, la cadena se "enchueca" hacia abajo. Mientras que su correspondiente isómero trans, el trans-9-hexadecanoato no tiene esa característica:
Esta característica es muy importante en los organismos. Con la luz o el calor, estos isómeros se pueden interconvertir, es por eso que cuando cocinas con ácidos grasos cis, es muy probable que los conviertas a trans. Pero un efecto sorprendente es el del retinal. Cuando el 11-cis-retinal recibe luz, cambia a su isómero todo-trans-retinal
recibe luz, cambia a su isómero todo-trans-retinal , eso hace que se dispare una señal, y dependiendo de la proteína (llamada opsina) a la que está unida el ojo detectará cierto color. Así que no se te olvide, puedes ver, gracias a la isomería geométrica.
, eso hace que se dispare una señal, y dependiendo de la proteína (llamada opsina) a la que está unida el ojo detectará cierto color. Así que no se te olvide, puedes ver, gracias a la isomería geométrica.
 recibe luz, cambia a su isómero todo-trans-retinal
recibe luz, cambia a su isómero todo-trans-retinal , eso hace que se dispare una señal, y dependiendo de la proteína (llamada opsina) a la que está unida el ojo detectará cierto color. Así que no se te olvide, puedes ver, gracias a la isomería geométrica.
, eso hace que se dispare una señal, y dependiendo de la proteína (llamada opsina) a la que está unida el ojo detectará cierto color. Así que no se te olvide, puedes ver, gracias a la isomería geométrica.
Por cierto, gastamos un ATP para regresar el trans-retinal a su isómero original el 11-cis-retinal. Así que el simple acto de ver gasta energía.
Isomería conformacional
Aunque hay varios tipos de isomerías conformacionales. A la que me referiré aquí, es a la isomería a través de rotación de enlace, es decir a los rotámeros de forma eclipsada o alternada. Esta isomería ocurre cuando ves dos átomos unidos entre sí, y entonces uno queda detrás del otro. Pongamos de ejemplo, la acetilcolina:

Si la ves desde enlace entre los carbonos del centro:

verías a el carbono 1, que tiene unido un acetilo (abreviémoslo Ac) adelante y al carbono 2, que tiene un trimetilamonio atrás (Abreviémoslo Ta). Nota que en la proyección que está aquí abajo a la derecha, el Ac lo puse hacia arriba, aunque en la fórmula desarrollada de la izquierda parece estar abajo. Por cierto, la de la derecha se llama proyección de Newmann.
Pueden estar eclipsadas cuando los enlaces están "encima" o alternadas cuando están un sustituyente del de atrás y luego uno de adelante. De hecho, podríamos tener tres conformaciones alternadas:



y tres eclipsadas:
En el caso de la acetilcolina como el carbono 2 y 1 tiene un sustituyente importante (Ac para el 1 y Ta para el 2), se puede tener la conformación syn, que sería la eclipsada donde están justo uno detrás del otro:

y la conformación anti, donde uno estaría detrás del otro. Esta sería la más estable:


Este movimiento que parece libre, es reconocido por las moléculas biológicas. Por ejemplo, en el sistema nervioso autónomo del humano, los receptores nicotínicos reconocen la conformación syn, mientras que los muscarínicos reconocen la anti. Por ejemplo, un receptor muscarínico, el M3, provoca que se contraigan los bronquios de los pulmones. En contraste, los nicotínicos se encargan de otras funciones, una de ellas es el que puedas moverte! Así que las diferentes respuestas en las conexiones post-sinápticas dependen de cambios en la conformación de la acetilcolina.
Pero, ¿qué provoca estos cambios? Bueno, eso será un tema que veremos en bioenergética.
Isomería óptica o Estereoisomería
La isomería óptica se llama así porque los isómeros ópticos tienen la capacidad de rotar el plano de la luz polarizada. Esta se da cuando los cuatro sustituyentes de un carbono son diferentes y están ordenados de manera diferente. Aunque la nomenclatura R-S que sigue las reglas Cahn-Ingold-Prelog es más precisa y apropiada, en Bioquímica aún usamos la nomenclatura D-L que a su vez, usa la proyección de Fischer. También se usa, aunque ya menos en la actualidad, la nomenclatura d-l (dextrógiro-levógiro) que depende de si el compuesto gira el plano de la luz polarizada a la derecha o a la izquierda. Nota que la nomenclatura D-L y la d-l no son lo mismo. La d-l implica que se sabe en qué sentido gira la luz polarizada de todo el compuesto, pero para evitar la confusión ahora se usa (+) y (-). La D-L solo se refiere a la proyección de Fischer y no tiene que ver con el sentido de la luz polarizada. Ahora bien, tal vez lo desconozcas, pero la nomenclatura D-L solo sirve para un átomo de C y sigue tres reglas:
1a regla)
El carbono quiral o asimétrico se coloca en el centro de una cruz. La línea vertical representa a los sustituyentes atrás del plano (en tu caso, los que estarían atrás de la pantalla, alejándose de tí). La línea horizontal representa a los que están delante del plano (en tu caso, los que están entre la pantalla y tú, como si se te estuvieran acercando).
Pongamos de ejemplo a la Alanina, un aminoácido cuyo segundo carbono, el carbono alfa al grupo carboxilato, es quiral.
Ahora bien, los demás sustituyentes no se ponen al azar, se sigue la regla.
2a. regla)
El carbono más oxidado se coloca arriba y el menos oxidado abajo. En realidad es el sustituyente con el carbono más oxidado y así...
Eso implica que dos de los sustituyentes son carbonos o cadenas carbonadas y estos dos están atrás de la pantalla. Tienes que conocer los grados de oxidación (ver abajo). En este caso el carbono más oxidado es el carboxilato (GO=3), por eso se pone arriba. El menos oxidado (GO=0) es el metilo (GO=0) y por eso se pone abajo. Nota que el hecho de ponerlo abajo, implica que va hacia atrás. OJO, aunque en la proyección de Fischer podemos ponerlo como queramos, esta regla es para conocer la configuración D o L.
3a. regla)
La configuración se determina a partir del lado donde quede el heteroátomo (o el átomo diferente a H). Si el sustituyente queda a la derecha el isómero es D, si queda a la izquierda es L.
Por ejemplo, el isómero D-Alanina sería así:
y la L-Alanina sería:

Recuerda que la D o L solo es para indicar la isomería óptica o esteroisomería. No indica si es (+) o (-) respecto a si es dextrógira o levógira. De hecho, la D-Alanina es levógira (gira 13º a la izquierda el plano de la luz polarizada), mientras que la L-Alanina es dextrógira (gira 14.5 º a la derecha el plano de la luz polarizada). Así que ¡Cuidado! no confundas la isomería D-L con la capacidad de rotar el plano de la luz polarizada.
Nota que si algo se dibuja con los sustituyentes sin el orden según las reglas, puedes equivocarte. Recuerda, los que están arriba y abajo están hacia atrás y los de los lados hacia adelante, así que para dar la configuración tienes que rotarlos imaginariamente hasta dejarlos en las posiciones como describimos arriba.
Por ejemplo, alguien podría representar la serina así, ¿qué representa un isómero D o L?
Pues como te podrás imaginar, este isómero es L-Alanina. Recuerda que el metilo y el carboxilato están hacia atrás, si giras la molécula para que quede el más oxidado arriba, te darás cuenta que el radical amonio queda del lado izquierdo, y por tanto, es isómero L.
¿Y qué pasaría con la Glucosa que tiene 4 carbonos quirales?

Bueno tendrías que dibujarlos e ir colocando para cada carbono los sustituyentes, y entonces girarlos para que queden como deben. Esta parte es importante, porque el Carbono 2 (que es el primer C quiral) es fácil de asignar pero cuando pases al tres, el 2 que estaba en el plano, lo deberás pasar hacia atrás!
Así que un dibujo plano de isomerías D-L con proyecciones de Fischer no representa la estructura 3-D. Compara (carbonos en negro, oxígenos en azul):
La figura de la derecha ya tiene todas las isomerías aplicadas incluyendo la conformacional, te podrás dar cuenta que casi forma un ciclo, pero no es un ciclo, solo que la estructura tridimensional hace que se acerque mucho.
Entra a esta página de Estructura 3D y dibuja una glucosa verifica que la conformación D-L sea la correcta. La siguiente estructura fue hecha ahí (carbonos en gris, oxígenos en rojo):

Nota que los Carbonos 4 y 5 que están con una flecha (aquí abajo) que tienen sus -OH "aparentemente" cerca en la proyección -plana- de Fischer, esto es, que están del mismo lado, ya en la estructura 3D claramente están uno opuesto al otro.


Esto se debe, tanto a la isomería óptica, como a la conformación, pues tendrían que estar en anti-. Ponerlos en conformación anti-, que sería la mas estable, hace que queden opuestos, y eso hace que la estructura de la Glucosa en realidad se acerque a ser un ciclo, como te mencionaba arriba.
Checa si entendiste los conceptos de isomería, contestando este Kahoot sobre isomería.
Oxidorreducción biológica
Seguramente recordarás oxidorreducción de tus clases de química inorgánica y de química orgánica. A veces, tendemos a olvidar que en los compuestos orgánicos también hay grados de oxidación. Primero recordemos.
Reducción es cuando un átomo o molécula recibe electrones.
Oxidación es cuando un átomo o molécula pierde electrones.
Así, cuando el Fe (2+) se convierte a Fe (3+), dado que perdió un electrón, decimos que se oxidó. O cuando el Oxígeno O2 pasa a O (2-), decimos que se redujo, porque recibió 4 electrones (dos para cada átomo).
En las moléculas orgánicas también ocurre la oxidorreducción. Este proceso se puede saber por la valencia o el grado de oxidación, pero estos son cosas diferentes.
Valencia
La valencia del Carbono se calcula a partir de la suma de las valencias de los demás. Usualmente se considera valencia de +1 para H y -2 para oxígeno (y -3 para nitrógeno). Como la suma de todas las valencias en una molécula debe ser 0, se calcula la valencia del carbono por resta.
Por ejemplo, para el piruvato C3H4O3, la suma de todas las valencias debe dar 0, entonces como tengo 4+ de los hidrógenos y 6- de los oxígenos, significa que los tres carbonos en conjunto darían una valencia de +2. Eso significa que la valencia de cada Carbono es 2/3. En efecto, las valencias de carbonos en las biomoléculas son frecuentemente un número fraccionario. Entonces la valencia se calcula en total para todos los carbonos, puede ser o no un número fraccionario, pueden ser positiva o negativa o incluso 0.
¿Cuál sería la valencia del Carbono en un monosacárido C6H12O6?
La respuesta más abajo...
Grado de oxidación
Los grados de oxidación GO se miden para cada carbono y solo pueden ser 0, 1, 2, 3 o 4. De hecho, el 4 no existe en moléculas orgánicas.
El grado se mide a partir del número de enlaces sencillos a heteroátomos -átomos diferentes a C e H- que tenga cada carbono. Veamos,
Grado de oxidación (GO) 0, sería cuando todos sus enlaces están a C o Hidrógeno, es decir, un alcano, ya sea cíclico o alifático sería GO 0, porque tiene sus cuatro enlaces a diferentes C o H.

GO 1 es cuando uno de los enlaces ya no está a diferente C o H, esto puede ocurrir de dos maneras, 1) que un enlace se dirija a otro átomo como O o N, o 2) que el enlace se pierda y se convierta en doble enlace. Así que los carbonos del grupo alcohol, éter, amina, tiol, tioéter y el alqueno tienen grado de oxidación 1.






GO 2, es cuando otro enlace más (dos en total) ya no están a diferentes C o H, esto ocurre porque un enlace más está hacia el mismo oxígeno u otro, o porque se perdió otro enlace sencillo. Ejemplos de grado 2 son carbonos en el grupo carbonilo, y su tautómero enol,



O en el grupo imina,

o alquinos
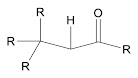
GO 3, es cuando solo le queda un enlace a otro Carbono o Hidrógeno y todos los demás son enlaces sencillos, dobles o triples a heteroátomos. Ejemplos son el carbono del ácido carboxílico

Los ésteres (en el carbono del lado del carboxilato, porque el del alcohol tendría grado 1) y el de la amida (el del lado del carboxilato, porque el carbono que solo se une a un nitrógeno tendría grado 1).
y el carbono del grupo nitrilo

GO 4. Este solo ocurre cuando todos los enlaces se dan hacia átomos que no son ni H ni oxígeno. Como podrás imaginar, los únicos compuestos donde el C tiene grado 4 son el anhídrido carbónico (mal llamado dióxido de carbono):
y el ácido carbónico y sus especies (bicarbonato y carbonato):
Pero, estrictamente hablando estos no son compuestos orgánicos ni biológicos, por lo que no pertenecen a la química orgánica, por eso, arriba te escribí "De hecho, el 4 no existe en moléculas orgánicas".
Quiz: ¿Cuál sería el grado de oxidación del carbono en el formaldehído ?
?
 ?
?Bueno, como puedes notar tiene dos enlaces a oxígeno, por tanto su grado de oxidación es 2. Los otros dos enlaces son a hidrógenos y esos no se cuenta para el grado de oxidación. Dicho de otra manera, el grado de oxidación se calcula a partir del número de enlaces a átomos diferentes (que no son ni H ni C) o dobles y triples enlaces, el doble enlace cuenta como un grado de oxidación y el triple como 2.
¿cuántos enlaces a heteroátomos? Ninguno, ¿Cuántos enlaces a dobles enlaces? 2, como cada doble enlace cuenta como 1, entonces el grado de oxidación es 2. El carbono del centro tiene grado de oxidación 2, mientras que los carbonos de los extremos tienen grado de oxidación 1.
Otra forma de calcular el grado de oxidación es 4-(Número de enlaces a C e H diferentes). En el ejemplo de acetileno, para el Carbono de en medio, tiene 2 enlaces a Carbonos diferentes, por tanto su grado de oxidación es 4-(2)=2. En el formaldehído, tiene 2 enlaces a C/H diferentes, por tanto es 4-(2) su grado de oxidación. Prueba, cuál forma de calcular se te hace más fácil de entender y usa esa.
Quiz: ¿Cuál sería el grado de oxidación para cada carbono en la glucosa?

Para el primer carbono (que está hasta arriba) su grado de oxidación es 2, para todos los demás carbonos, el grado de oxidación es 1. Nota que esto no tiene nada que ver con la valencia de los carbonos que es 0, que es la respuesta a la pregunta de arriba, en la sección de valencia.
Revisa si has entendido, resolviendo este Kahoot de grado de oxidación.
Importancia del grado de oxidación y la valencia en metabolismo
El grado de oxidación es muy importante en orgánica y en bioquímica. En orgánica por que te permite dar la numeración de carbonos. Siempre los carbonos de los extremos que tengan el grupo más oxidado snon los que llevan el número 1. También sirve para la proyección de Fischer, porque el carbono más oxidado (con mayor grado de oxidación) se debe colocar arriba y el menos oxidado abajo. En bioquímica además, la oxidación te permite entender procesos.
Cuando un Carbono aumenta su grado de oxidación (por ejemplo, pasa de grado 0 a 1), decimos que se oxidó. Como esta oxidación implica pérdida de hidrógenos, es muy común que digamos que se "deshidrogenó". Lo mismo a la inversa, si su grado de oxidación disminuye, decimos que se redujo o se hidrogenó.
El metabolismo de un organismo -la vida misma- está basado en reacciones redox. Cuando comemos, partimos de macromoléculas y las hacemos más pequeñas, -proceso llamado catabolismo-, y también las oxidamos hasta CO2 (grado 4). Por ejemplo, la glucosa de grado de oxidación 1 y 2, se oxidan hasta grado 4.
En el catabolismo, tomamos los electrones de los compuestos y los transferimos a moléculas llamadas cofactores, lo que da energía para todos los procesos biológicos. Estos cofactores son el NAD+, NADP+ y FAD. Cuando estos toman los electrones, es decir, cuando se reducen se convierten a NADH, NADPH y FADH2, estos son llamados cofactores reducidos y cada uno toma dos electrones al reducirse. Estos Cofactores reducidos son la principal moneda energética redox de TODOS los organismos. La otra moneda energética, seguramente ya la has escuchado, el ATP, pero este no proporciona energía redox, solo energía que denominamos química.
En el anabolismo se usan moléculas pequeñas y se reducen (se les dan electrones) o utilizan para formar moléculas más grandes. En este proceso, los cofactores reducidos y el ATP se convierten a cofactores oxidados y ADP+Pi. Así, el metabolismo es una homeostasis entre el catabolismo y anabolismo.
Cuando un Carbono se oxida de 0 a 1, se genera 1 NADH, con excepción de cuando esa oxidación da como resultado un alqueno. En ese caso, se genera 1 FADH2.
Cuando un Carbono se oxida de 1 a 2, o de 2 a 3, o de 3 a 4, se genera 1 cofactor reducido por cada paso de oxidación. Este cofactor puede ser 1 NADH o 1 NADPH.
Podemos decir que cada incremento en un grado de oxidación implica la generación de 1 cofactor reducido.
Así, en la oxidación de la Glucosa a CO2 se puede calcular cuántos cofactores reducidos produciría:
Un carbono de grado de oxidación 2 se oxida dos veces para llegar a 4, lo que significa que produciría 2 cofactores reducidos.
De los otros carbonos que son grado de oxidación 1, la oxidación de un carbono 1 hasta 4 produciría tres cofactores reducidos, (cada carbono). Entonces la oxidación de los cinco carbonos produciría 15 cofactores reducidos.
En total la oxidación de la glucosa podría producir 17 cofactores reducidos, pero en realidad solo produce 12, el 70%. ¿Por qué la diferencia? porque los grados de oxidación no miden la cantidad de electrones que se donan, para eso se usa la valencia. Sin embargo, si nos permiten medir los cambios estructurales, reacción por reacción (lo veremos con más claridad, más adelante).
Desde el punto de vista de valencia también se puede hacer el cálculo. Recordemos que cada cofactor toma dos electrones para reducirse, es decir que por cada dos electrones de cambio de valencia se genera 1 NADH. Entonces, en la oxidación de la Glucosa, donde el Carbono tiene valencia 0, la oxidación a CO2, cuya valencia es 4, significa que se donan 4 electrones por cada carbono. Dado que son 6, entonces eso implicaría que se donan 24 electrones, lo que sería igual a 12 cofactores reducidos.
Quiz: ¿Cuántos Cofactores reducidos produciría el catabolismo del ácido palmítico C16H32O2?
(Pregúntale la respuesta a tu profe de Bioquímica)
¡¡La valencia sí nos permite calcular el número de cofactores reducidos que se producirán!!
Esta es la razón por la cual, en bioenergética usamos la valencia, pero para las estructuras, reacciones y nomenclatura, usamos el grado de oxidación.
La generación de cofactores reducidos y ATP son la función del metabolismo primario. ¿a qué nos referimos con primario?
Niveles de metabolismo
Metabolismo primario se refiere al conjunto de reacciones necesarios para la vida. La producción de cofactores reducidos y ATP pertenecen a este. Las reacciones pueden presentar pequeñas variaciones entre organismos taxonómicamente diferentes, pero todos los organismos lo necesitamos.
Metabolismo intermediario se refiere al conjunto de reacciones que son necesarias para un organismo, pero que no se comparten con todos los demás organismos. Por ejemplo, la producción de hormonas esteroideas o de reguladores de nuestro organismo como la hormona de crecimiento, que son necesarias para vivir, pertenecen a metabolismo intermediario. Otro ejemplo, sería la producción de vasos leñosos en la planta, o la producción de peptidoglicano en las bacterias. También la producción de moléculas de almacenamiento (como almidón, glucógeno o volutina) que permiten guardar moléculas necesarias para la vida, pertenecen al metabolismo intermediario.
Metabolismo secundario se refiere a reacciones que son un organismo puede prescindir y seguir existiendo. Pueden darles ventajas evolutivas o ecológicas pero si faltaran podría seguir existiendo. La producción de pigmentos en animales y plantas es metabolismo secundario, la producción de sideróforos en bacterias es metabolismo secundario. OJO, la producción de pigmentos fotosintéticos pertenece a metabolismo intermediario, porque sin ellos el organismo fotótrofo podría morir.
Los límites entre metabolismo intermediario y secundario a veces son un poco complicados, de ahí que esta distinción de niveles se usa poco para distinguir rutas. Más bien, se utiliza para agrupar rutas metabólicas cuando nos queremos referir a varias.
Dicho eso, en los cursos de bioquímica, usualmente se estudian metabolismo primario y algunas rutas de metabolismo intermediario, dependiendo del enfoque de la materia. En bioquímica médica se incluyen metabolismo intermediario humano (síntesis de prostaglandinas, síntesis de hormonas esteroideas, síntesis de glucógeno). Para químicos se incluyen ejemplos de metabolismo de todos los niveles taxonómicos (síntesis de almidón, síntesis de hemo, síntesis de peptidoglicano y derivados de paredes celulares bacterianas, fúngicas y vegetales). Para biotecnología se incluyen metabolismo intermediario y secundario que tiene fuertes aplicaciones en las diferentes ramas de la biotecnología (síntesis de almidón, síntesis de bioplásticos bacterianos, ruta de flavonoides, acetogeninas y polifenoles, síntesis de fosfolípidos y triacilglicéridos, ciclo biogeoquímico del azufre, nitrógeno, fósforo y carbono)
El dibujo que uso mucho para este blog (que pongo aquí abajo) representa una bacteria y una molécula de metabolismo intermediario: el catecolato de Fe+3. ¿por qué me gusta usarlo? Porque me gusta la microbiología, pero además, porque para mí representa mucho de lo que es la bioquímica: compuestos orgánicos e inorgánicos con una función biológica. El catecolato es un aleloquímico, inhibe el crecimiento de otras bacterias, es producido por bacterias y por plantas y también como subproducto del petróleo. Permite que algunas bacterias puedan tomar el Fe que lo necesitan para sus hemo-derivados. Claro que una bacteria no usa hemoglobina, pero vaya que usa citocromos!. Dado que implican varias funciones, me gusta incluirlo. Usualmente, cuando se menciona la palabra bioquímica entre profesionistas, generalmente se evoca la imagen de Ciclo de Krebs, pero la bioquímica va mucho más allá, y no solo estudia al humano. Así que el Fe+3 es parte del metabolismo primario y el catecolato del intermediario y secundario.









 representa
representa
















No hay comentarios:
Publicar un comentario