Acidez y Basicidad

Hay tres definiciones de ácido/base
La primera definición es la de Arrhenius, fue de las primeras aproximaciones y sigue siendo un concepto válido en algunas ocasiones. Arrhenius clasificaba a los ácidos como aquellos con la capacidad de donar un ion hidrógeno (que comúnmente le llamamos protón, aunque desde el punto de vista atómico no solo es un protón) o de que se disociaban liberando un protón. En contraste las bases son aquellas con capacidad de donar un ion hidroxilo.
HA +H2O ---> H3O+ + A-
De esta manera, HA es un ácido porque puede disociarse, liberando el ion H+. Un ejemplo típico sería el HCl o el HNO3. Nota que aunque es común que pongamos H+, es más correcto poner H3O+, pues en realidad el ion H+, es decir el hidrógeno iónico solo no existe, o al menos no se ha probado, de ahí que el concepto de acidez de Arrhenius se limita solo a soluciones acuosas. De hecho, debido a los puentes hidrógenos es más probable que exista como ion hidronio. Actualmente, sabemos que algunos solventes próticos también pueden, de manera parecida al agua, permitir la presencia de ácidos o bases. Sin embargo, la escala de acidez y basicidad es diferente en otros solventes.
Ahora bien, esta definición permitió definir la escala de acidez basados en la concentración de ion hidrógeno. Como la mayor parte de las concentraciones de ion hidrógeno son menores a 1, es decir son cantidades muy pequeñas es común que eran exponentes negativos de 10, como 10^-6 o 10^-5 M. Entonces para no tener que estar escribiendo todo lo de 10^- se decidió trabajar con los exponentes negativos directamente; para obtener el exponente, simplemente calculas el logaritmo (recuerda que el logaritmo es el exponente al que se eleva el 10 para obtener el valor final). El logaritmo de 10^-5 es -5. Entonces, para no estar trabajando con los valores en menos, se decidió cambiarles el signo menos. Así salió la fórmula para potencial,
potencial=-log
Así el potencial de hidrógeno, será el -log de la concentración de hidrógeno. Pero puede haber potencial de Y o potencial de la constante de equilibrio (K), que se denomina pY y pK.
pH=-log[H]
El potencial hidrógeno se calcula a partir del logaritmo negativo de la concentración de iones hidronio.
Solo no se te olvide que también el potencial es en realidad una función matemática que usamos mucho en química y bioquímica para no tener que trabajar con exponentes negativos.
Nota ortográfica: aunque en muchos textos verás que nos encanta poner Hidrógeno con H mayúscula, solo para recordar la sigla H, desde el punto de vista ortográfico es incorrecto, los nombres de elementos comienzan en minúsculas, salvo que inicien frase.

La segunda clasificación es la de Bronsted & Lowry. En esta, el ácido también es aquel capaz de ceder un protón (ion hidrógeno), pero la base está definida como aquella capaz de aceptar un protón. Eso implica que en una especie ácida, se convierte en base después de disociarse.
Por ejemplo, el HCl, es un ácido porque puede ceder un protón, pero cuando lo hace, queda un cloruro. Este cloruro es una base porque podría tomar el H para formar el HCl. De ahí que se habla de que en compuestos químicos, los ácidos devienen en bases después de ceder su protón.
A estas dos especies se les llama par conjugado, y entonces a la especie ácido, se le llama ácido conjugado y a la especie básica, base conjugada. En el ejemplo de arriba, HCl sería el ácido conjugado y el ion cloruro la base conjugada. Así que podemos hablar del par conjugado HCl/Cl-.
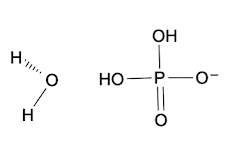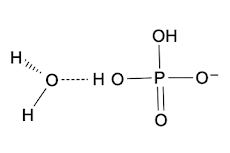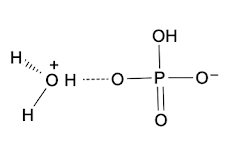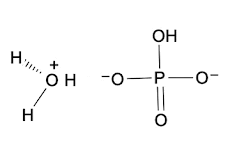
Otro ejemplo, el ácido ortofosfórico H3PO4 es un ácido débil.
Se disocia en ion hidrógeno y fosfato diácido H2PO4- :
En el par conjugado ácidos fosfórico/fosfato ácido, el ácido fosfórico es el ácido conjugado y el fosfato diácido es la base conjugada.
Nota como la reacción podría ocurrir al revés, es decir que el fosfato ácido tome el protón para convertirse en ácido fosfórico:
De ahí que en ese par conjugado, el fosfato diácido es la base conjugada.
No obstante, como te darás cuenta, el fosfato diácido todavía tiene hidrógenos que puede donar y convertirse en fosfato monoácido (HPO4 2-).
De esta manera el fosfato diácido es base conjugada del ácido fosfórico, pero ácido conjugado del fosfato monoácido.
A las sustancias que pueden funcionar como ácidos o como bases se les llama anfolitos. El fosfato diácido es un anfolito.
De hecho, el fosfato monoácido, también es un anfolito, pues puede ser el ácido conjugado del fosfato PO4 (3-). El fosfato monoácido es base conjugada del fosfato monoácido.
Dado que el concepto de ácido/base conjugados implica que un ácido se convierte a base y viceversa, entonces la definición de ácido y base se puede también extenderse a iones hidroxilo OH- .
Así, una base es aquella capaz de donar iones hidroxilo y un ácido es capaz de aceptar iones hidroxilo. Uno de los ejemplos más claro es el amoniaco NH3. Cuando el amoniaco se disuelve en agua puede estar disuelto como amoniaco o como hidróxido de amonio NH4OH. Ambas especies, por supuesto son ácidas porque el hidróxido de amonio solo es el amoniaco hidratado. Así, la especie que originan lel ion amonio es ácido.
Si lo ves desde amoniaco:
NH3 + H+ ---> NH4+ (reacción A1)
O desde el hidróxido de amonio:
NH4OH ----> NH4+ + OH- (reacción A2)
Con ambas definiciones de Bronsted & Lowry, puedes ver que respecto al ion H+, en la reacción A1 el amoniaco es una base porque acepta un hidrógeno para convertirse en amoniaco que es su ácido conjugado. Respecto al ion hidróxido, el hidróxido de amonio (reacción A2) es una base porque es capaz de donar un hidroxilo para quedar como amoniaco, que es su ácido conjugado. Así, el amonio es un ácido conjugado de la base conjugada amoniaco (ya sea que la veas sola o como hidróxido de amonio).
Esta definición de ácidos y báses -de Bronsted & Lowry- es una de las que más usamos en Bioquímica, para cuando se inicia en la materia y para explicar de manera sencilla varios fenómenos.
Hay que recordar que los pares conjugados de ácidos y bases débiles y de media fuerza están en equilibrio entre sí. Eso implica que cuando los colocas en solución se va a generar su par conjugado, lo que implica que no se va a disociar completamente y entonces el pH va a depender del grado de disociación
Quiz: En el ácido acético, que puede disociarse a acetato. ¿Cuál es la base conjugada?
La tercera y última definición es la de Lewis, en esta definición, ácido es aquel capaz de aceptar electrones y base aquella capaz de dar electrones. Otro nombre para los ácidos es electrófilos y para la base, nucleófilos.
Esta definición nos permite entender muchos de los mecanismos de reacción, también nos permite evaluar la estabilidad de compuestos orgánicos, dado que hay reglas de basicidad para ver cuál es el compuesto más estable.
En general, podemos decir que los átomos que tienen orbitales con un par de electrones sin compartir (como el átomo de N u O) son nucleófilos y por tanto funcionan como bases. Aquellos que requieren electrones o comparten el par de electrones (generalmente tienen carga positiva, pero no es regla) y por tanto están deficientes en electrones son electrófilos.
Usemos de ejemplo los que hemos visto:
Amoniaco. Dado que el Nitrógeno del NH3 tiene un orbital con dos electrones, es considerada una base. Notarás, que las diferentes definiciones (Arrhenius, Bronsted & Lowry, y Lewis) coinciden. De hecho, el amoniaco es un ejemplo sencillo que permite revisar los conceptos de los tres y aunque las concepciones son diferentes, coinciden en el carácter ácido o básico de las sustancias.
Nota que el amonio, al tener carga positiva tiene afinidad por los electrones por lo que, de acuerdo con la clasificación de Lewis, sería un ácido. Esto también coincide con las otras definiciones, la de Arrhenius, y la de Bronsted & Lowry. Si ves la reacción A1, en sentido inverso, es claramente una disociación del amonio en ion hidrógeno y amoniaco.
Por último, recuerda que los ácidos débiles y de media fuerza no se disocian totalmente, sino que cuando se encuentra en solución, hay un equilibrio entre ambas especies del par conjugado. Usemos de ejemplo al ácido fórmico.
HCOOH <---> HCOO- + H+
El ácido fórmico (a la izquierda) se disocia en formato (o formiato) e ion hidrógeno.
La expresión de la constante de Equilibrio químico, de acuerdo a la ley de acción de masas quedaría:

En realidad, aunque ponemos concentración la Constante se define sobre la base de actividad. Sin embargo, en soluciones diluidas (< 100 mM), la expresión en concentración podría ser suficiente.
Bueno, puedes notar que si en el equilibrio las concentraciones fueran iguales es decir que la concentración del ácido conjugado fuera de x, la de la base conjugada de x y la del ion hidrógeno x, entonces la Keq sería igual a x. Pero no es el caso, es muy frecuente que las constantes también son muy pequeñas, en el caso de la Keq del ácido fórmico, su valor es de 10^-3.745. Como también los valores son pequeños, es decir, son exponentes del diez negativos, también se le aplica la función p. El pK de acidez (llamada pKa) del ácido fórmico es de 3.745.
Nota que el valor es muy pequeño, es decir que la concentración al equilibrio de la base conjugada y del ión hidrógeno es realmente más pequeña que la del ácido. A este se le llama ácido débil, porque se disocia poco. Los ácidos débiles tienen pK entre 2 y 12.
Se clasifican los ácidos débiles de acuerdo a la diferencia entre pK y el pC. Este último es el -logaritmo (base 10) de la concentración formal de la especie (el par conjugado). Si pK-pC es igual o mayor que 1, se considera ácido débil, si pK-pC está entre -1 y 1, se considera ácido de media fuerza. Si pK-pC es menor a -11 entonces se considera fuerte.
Eso significa que para el ejemplo del ácido fórmico, este se consideraría débil a un pC de 2.745 o menos, es decir que la concentración fuera igual o mayor a 1.7 mM. Se consideraría ácido de media fuerza si su pC está entre 2.745 y 4.745, es decir, entre 1.7 mM y 0.017 mM, y se consideraría fuerte si está por debajo de 0.017 mM. OJO, el que sea fuerte no significa que el pH vaya a ser muy bajo, sino que se va a disociar casi totalmente. A esa concentración, aún cuando se disocie totalmente, el pH no podría llegar por debajo de 4.745. ¿Recuerdas la nota que te pusimos arriba? la fuerza del ácido no significa que vaya a dar pH bajo, la fuerza de un ácido se relaciona a qué tanto se disocia.
Un error muy común es que los estudiantes piensan que el ácido débil siempre va a ser débil, pero como te habrás dado cuenta, depende de su concentración, para el ácido fórmico:
Se comporta como: a la concentración:
Débil > 1.7 mM
Media fuerza entre 0.017 y 1.7 mM
Fuerte < 0.017 mM
¿Este límite de concentración será diferente para otros ácidos?
CLARO, recuerda que el criterio es pK-pC, por lo que depende tanto de la Constante de equilibrio como de la concentración. Como la Keq depende de la naturaleza del compuesto, entonces estos límites también dependerán de la naturaleza del compuesto.
de la fórmula de la Constante de Equilibrio, podemos despejar la concentración de iones hidrógeno.
Eso lo podríamos generalizar para cualquier par conjugado

y si aplicamos la función p, entonces nos quedaría

Esta ecuación se llama, Ecuación de Henderson-Hasselbach, en honor a los bioquímicos que la desarrollaron (en realidad eran químicos-físicos, pero terminaron aplicando cosas a biología por lo que les llamamos bioquímicos, o más asertivamente bioquímicos físicos).
Esta ecuación sirve para poder saber qué pH tendrá una solución si colocas un ácido y su base conjugada, pero si solo colocas una especie, esta ecuación no te sirve, para eso requieres las ecuaciones de Charlot (Formulario de soluciones JBVF).
Una de las utilidades de esta ecuación es que puedes saber la proporción de ácido y base conjugada al despejar la proporción:

Así, puedes notar que a valores de pH menores a pK, la especie que va a prevalecer va a ser el ácido conjugado, y cuando el pH > pK, la especie que prevalecerá será la base conjugada. Y si son iguales pH y pK, entonces las concentraciones de ácido y base conjugada, también serán iguales.
Condición Especie que prevalece
pH > pK Base
pH = pK [Base]=[Ácido]
pH < pK Ácido
Eso significa que si tú cambias el pH puedes cambiar la proporción entre ácido y base conjugada. Esto tiene un efecto muy útil en bioquímica. Algunos procesos biológicos dependen del pH directamente y otros es porque el pH afecta la proporción entre ácido y base de compuestos que pueden ser activos biológicamente. Hay compuestos en donde la especie tiene cierta actividad biológica y su par conjugado no. Pongamos un ejemplo
Los ácidos orgánicos (ácidos carboxílicos) tienen pK entre 2 y 7. Eso significa que el ácido orgánico RCOOH prevalecerá a pH por debajo de su pK, pero la base conjugada RCOO- que tiene carga negativa, prevalecerá a pH superiores al pK. El ácido podría interaccionar o incluso atravesar membranas bioógilcas porque no tiene cargas, la base conjugada, definitivamente no, por la carga. El ácido acetilsalicílico, permanece como ácido si el pH < pK, pero si pH > pK prevalece la forma disociada (acetilsalicilato). Como el pH en sangre es de 7.35-7.45, la mayor parte de los ácidos orgánicos se encuentre disociados, es decir, es la base conjugada la que prevalece. Pero si el pH bajara (como en el espacio intermembranal en la mitocondria o en el contenido estomacal) entonces podría prevalecer la especie no disociada.
Lo opuesto ocurre para las aminas orgánicas (RNH2) cuyo pK está entre 7 y 12. La especie ácida, que se llama sal de amonio (RNH3+) tiene carga positiva, mientras que la especie disociada, RNH2, no tiene carga. Eso significa que la base conjugada que no tiene carga prevalece a pH > pK.
Grupo funcional Especie prevaleciente a pH < pK Especie prevaleciente a pH > pK
Ácido carboxílico Ácido, especie sin carga Carboxilato Carga -1
Amina Sal de amonio, Carga +1 Amina, especie sin carga
Entonces, por ejemplo, el amonio, cuyo pK es de 9.25. A pH de 7, ¿qué especie prevalecerá?
En efecto, la especie que prevalece es la especie cargada, el ion amonio (NH4+). La especie sin carga, el amoniaco prevalecerá a pH por arriba de 9.25.
Es algo confuso, te invito a que hagas ejercicios. Recuerda que la ecuación de Henderson-Hasselbach no te permite predecir el pH de una solución en donde agregas solo un ácido o una base pero no su par conjugado. Las fórmulas para poder hacerlo las podrás encontrar en mi Formulario de soluciones JBVF.
Quiz:
Menciona de los siguientes compuestos, cuyo pKa está entre paréntesis, cuál especie prevalecerá a un pH de 6:
Ácido fórmico (3.745)
Ácido acético (4.76)
Ácido propiónico (4.87)
Hidroxido de amonio (9.25)
Etanolamina (9.50)
Guanidina (13.6)
Grupo amina de los aminoácidos (8-10)
Grupo ácido de los aminoácidos (3-5)
Resuelve este Kahoot sobre acidez





No hay comentarios:
Publicar un comentario